Molécula D-Glucosa
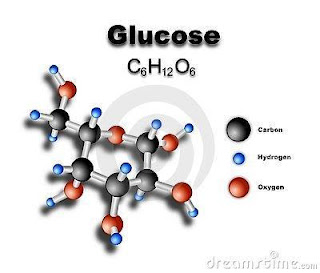
La D-Glucosa es el carbohidrato más abundante en la naturaleza. También se le conoce como azúcar sanguínea, azúcar de uva, o dextrosa. Los animales obtienen glucosa al comer plantas o al comer alimentos que la contienen. Las plantas obtienen glucosa por un proceso llamado fotosíntesis. Es una hexosa, es decir, que contiene 6 átomos de carbono, y es una aldosa, esto es, el grupo carbonilo está en el extremo de la molécula. La formula química de la D-Glucosa es C6 H12 O6 Los átomos enlazados en esta molécula son 6 carbonos, 12 hidrógenos y 6 oxígenos. Formula de esferas y barras Formula cíclica de Fischer Formula Haworth Propiedades Sus propiedades son orgánicas ya que se encuentra en plantas y/o en el torrente sanguíneo de los humanos en el que se conoce como “azúcar en sangre” Dentro de los alimentos se encuentras en algunas pastas, pan integral, cereales, lácteos, miel y en frutos como uva, manzana etc, Aplicaciones El cuerpo utiliza la glucosa

